Prävention und Therapie periimplantärer Infektionen
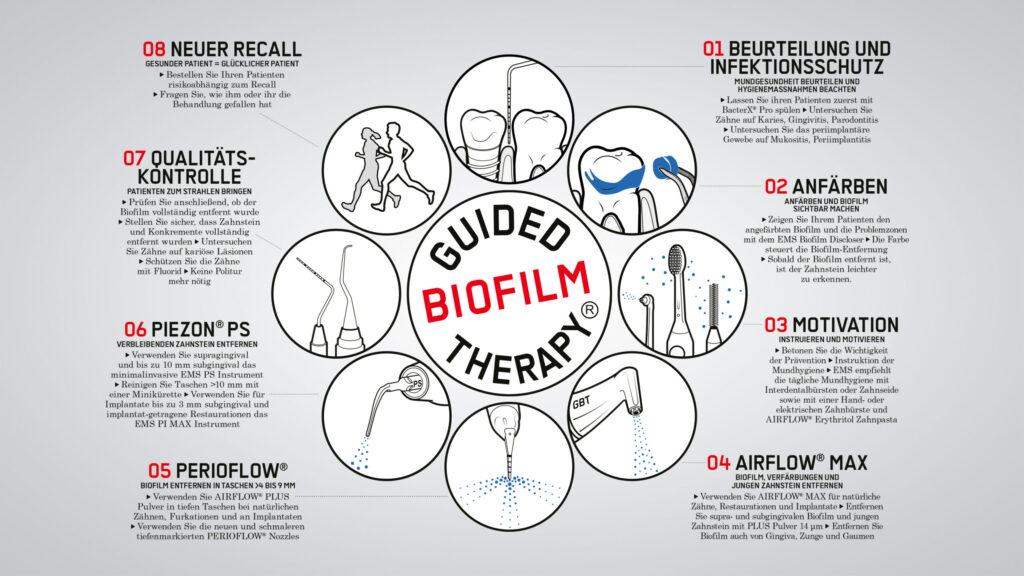
Guided Biofilm Therapie (GBT) in der nichtchirurgischen Therapie periimplantärer Erkrankungen
Nur mit einem systematischen und strukturierten Protokoll sind die Prävention und Therapie periimplantärer Infektionen erfolgreich. Die Autoren stellen ein systematisches Ablaufprotokoll mit acht Schritten von der Diagnose bis zu patientenindividuellen Recall-Intervallen vor, das auch als postoperative Prophylaxe einer unterstützenden Implantat-Therapie (UIT) erfolgreich angewendet werden kann: Die Guided Biofilm Therapie (GBT) ist als Bestandteil eines systematischen, präventiven Protokolls zu sehen.
Dr. Nadine Strafela-Bastendorf und Klaus-Dieter Bastendorf
Heute wissen wir, dass orale Erkrankungen eine multifaktorielle Genese haben. Als Hauptursache ist die „Ökologische Plaque-Hypothese nach Marsh“ [1] für die Ätiologie der wichtigsten oralen Erkrankungen weltweit akzeptiert. Nach dieser Hypothese ist der vitale supra- und subgingivale dysbiotische Biofilm die Hauptursache für orale Erkrankungen (Karies, Gingivitis, Parodontitis, periimplantäre Mukositis und Periimplantitis). Zusammengefasst heißt das: Der Biofilm bzw. das erfolgreiche Biofilmmanagement ist die biologische Herausforderung und der Schlüssel für eine erfolgreiche Prävention und Therapie aller oralen Erkrankungen, einschließlich der periimplantären Erkrankungen.
Mit zunehmender Zahl der Implantationen auf ca. 2 Millionen jährlich [2] steigt auch die Inzidenz periimplantärer Erkrankungen [3, 4, 5]. Für die Prävention und Therapie der periimplantären Mukositis und Periimplantitis existiert eine Reihe von Behandlungsansätzen. Obwohl es erhebliche physiologische, anatomische, biologische und mikrobielle Unterschiede zwischen natürlichen Zähnen und Implantaten gibt, sind die Behandlungsstrategien weitgehend aus der parodontologischen Prävention und Therapie abgeleitet und modifiziert worden.
Zusammengefasst heißt das: Die beste Behandlung von
plaquebedingten periimplantären Entzündungen ist die systematische Prävention. Regelmäßiges häusliches und professionelles Biofilmmanagement (Reinigung) ist unerlässlich. Ebenfalls notwendig sind regelmäßige Untersuchungen, um frühzeitig periimplantäre Erkrankungen zu erkennen und rechtzeitig zu behandeln. Die periimplantäre Mukositis lässt sich nichtchirurgisch behandeln. Die erfolgreiche nichtchirurgische Behandlung der Periimplantitis ist schwieriger, vor allem wegen des Problems der Dekontamination der aufgerauten, mit Gewinden versehenen Oberflächen der Implantate. Dennoch sollte der chirurgischen Periimplantitis-Therapie anlog der PA-Therapie eine minimalinvasive nichtchirurgische Therapie vorausgehen.
Wann liegt eine periimplantäre Erkrankung vor?
Die periimplantäre Mukositis ist eine biofilminduzierte Erkrankung. Die Homöostase zwischen Wirt und Mikroben an der Grenzfläche zwischen Implantat und Schleimhaut wird gestört, was zu einer entzündlichen Läsion führen kann. Das Ziel der nichtchirurgischen Behandlung der periimplantären Mukositis ist der Therapie der Gingivitis ähnlich. Die klinischen Symptome der Infektion müssen reduziert werden. Die periimplantäre Mukositis ist wie die Gingivitis eine reversible Erkrankung. Im Sinne der sekundären Prävention kann die Erkrankung mit einem optimalen Biofilmmanagement vollständig ausheilen. Das Verständnis der periimplantären Mukositis ist wichtig, da sie als Vorläufer der Periimplantitis gilt [6, 7, 8].
Periimplantitis ist ein pathologischer Zustand, der in den Geweben um Zahnimplantate auftritt und durch eine Entzündung des periimplantären Bindegewebes und durch einen fortschreitenden Verlust des stützenden Knochens gekennzeichnet ist. Periimplantitis-Stellen weisen klinische Anzeichen einer Infektion und eine erhöhte Sondierungstiefe auf. Das Ziel der nichtchirurgischen Behandlung der Periimplantitis ist es – analog der Parodontitis –, die Anzeichen der Infektion mit antiinfektiösen Therapien zu reduzieren. Erfolgreiche Behandlungen sollten zur Verringerung der Taschentiefe, Beendigung oder Verringerung der Blutung bei Sondierung/Suppuration und Stabilisierung des marginalen Knochenniveaus führen [7, 9]. Im Sinne der tertiären Prävention (Verhinderung des Fortschreitens oder Wiederauftreten der Erkrankung) können die nichtchirurgischen Therapieverfahren zu Verbesserungen der klinischen Parameter führen. Häufig jedoch zeigen die therapierten Stellen residuale BOP-Werte und weiter vertiefte Sondierungswerte [10].
Systematische, strukturierte Prophylaxe mit der GBT
Als Ergebnis des „11th European Workshop der EFP“ von 2015 wurde dazu aufgerufen, der Prävention von Parodontitis und Periimplantitis wieder mehr Bedeutung beizumessen [11]. Daher hat das Schweizer Unternehmen EMS, in Zusammenarbeit mit Praktikern und Hochschullehrern, die Recall-Stunde nach Axelsson/Lindhe [12] entsprechend neuen wissenschaftlichen Erkenntnissen und technischer Fortschritte angepasst und fortgeschrieben. Bei der GBT handelt es sich um ein am Risiko orientiertes, evidenzbasiertes, systematisches, strukturiertes, modulares, individuelles, universell anwendbares Präventions- und Therapie-Protokoll in acht Schritten (Abb. 1) [13]. GBT kann auch bei periimplantären Infektionen angewendet werden. Die professionelle Zahnreinigung (PZR) oder besser „Professional Mechanical Plaque Removal“ (PMPR) ist ein zentraler Bestandteil der systematischen Prophylaxe.
Zusammengefasst heißt das: Sowohl die Prävention als auch die Therapie der periimplantären Infektionen kann nur mit einem systematischen, strukturierten Protokoll erfolgreich sein. Die Anforderungen an systematische Ablaufprotokolle (auch bei periimplantären Infektionen) sind [11, 12]:
Diagnose (kontinuierliche Kontrolle von Risikofaktoren), häusliche Mundhygienemaßnahmen (Information, Instruktion, Motivation), professionelle mechanische Plaque-Reduktion (PMPR/PZR), lokalisierte subgingivale Instrumentierung bei Resttaschen und regelmäßige Recall-Termine. Die GBT wird all diesen Anforderungen gerecht.
Im Weiteren geht es um die postoperative Prophylaxe einer UIT (unterstützende Implantat Therapie) mit Hilfe des GBT-Protokolls. Diese unterstützende Betreuung für Implantate ist keine isolierte Einzelmaßnahme, sondern Bestandteil eines systematischen präventiven Protokolls.

Schritt 1: Infektionskontrolle/Beurteilung (Diagnose)
Vor der Behandlung reduziert eine Mundspülung mit einem antimikrobiellen Mittel die Anzahl der Mikroorganismen, die von einem Patienten in Form von Aerosolen/Rückspraynebel freigesetzt werden. Diese können die Geräte, Operationsflächen und das zahnärztliche Personal kontaminieren.
Ein entscheidendes Element für erfolgreiche Prävention ist die Befunderhebung, die Diagnose und das daraus abgeleitete Erkrankungsrisiko [11]. Es stehen uns moderne digitale Hilfsmittel für die Befunderhebung und Dokumentation aller oralen Erkrankungen – auch periimplantärer Infektionen – zur Verfügung. Diese Hilfsmittel erlauben nicht nur die Erfassung und Dokumentation der aktuellen Befunde und Risikofaktoren, sondern auch eine Verlaufskontrolle.
Um rechtzeitig Hinweise auf periimplantäre Infektionen zu erhalten, muss nach Eingliederung der Suprakonstruktion der Ausgangsbefund erhoben und dokumentiert werden. Nur im Abgleich mit den Ausgangswerten können die visuelle Inspektion, Palpation (Sekret- oder Pus-Entleerung), Sondierungstiefenmessung, BOP (besondere prognostische Bedeutung bei Implantaten), mukosale Rezessionen und Röntgenbefunde die notwendigen Informationen für ein rechtzeitiges präventives Eingreifen geben.
Schritt 2: Anfärben
Die aktuelle Literatur zeigt eindeutig, dass mithilfe des Anfärbens des Biofilms exaktere Plaque-Indices erstellt sowie bessere Ergebnisse bei der häuslichen Mundhygiene und bei der professionellen Entfernung von Biofilm erzielt werden [15, 16, 17].
Schritt 3: Motivation (häusliche Mundhygiene)
Präventive Erfolge setzen sich immer aus den Komponenten häusliches und professionelles Biofilmmanagement zusammen, das sogenannte 2-Säulen-Modell nach Axelsson/Lindhe [12]. Ein wichtiger Bestandteil der unterstützenden periimplantären Therapie (UIT) ist die regelmäßige Patientenmotivation und -nachschulung mittels Information und Instruktion, die kontinuierlich aktualisiert und angepasst werden muss [18].
Der Zusammenhang zwischen ungenügender Mundhygiene und einem periimplantären Knochenabbau wurde in mehreren Studien beschrieben. Das Risiko, eine Periimplantitis zu erleiden, war bei Patienten mit schlechter bzw. sehr schlechter Mundhygiene deutlich erhöht [18, 19, 20, 21, 22].
Zusammengefasst heißt das: Die häusliche Plaque-Kontrolle um Implantate ist unverzichtbar, sowohl für die Primär- und Sekundär-Prävention als auch für Tertiär-Prophylaxe der periimplantären Infektionen.
Schritte 4, 5 und 6: Biofilm- und Zahnstein- Management
Die Entfernung der entzündungsauslösenden Keime (Biofilm) ist das unstrittige Ziel der UIT. Neben der bereits erwähnten mechanischen Biofilmentfernung durch häusliche Mundhygienemaßnahmen spielt das professionelle, mechanische Biofilmmanagement eine entscheidende Rolle. Dafür stehen verschiedene Hilfsmittel zur Verfügung:
- spezielle Handinstrumente,
- Bürstchen und Kelche in rotierenden Handstücken (Rubber Cup Polishing/RCP),
- Schall-Ultraschallinstrumente und
- Pulver-Wasser-Strahl-Geräte (Air-Polishing)
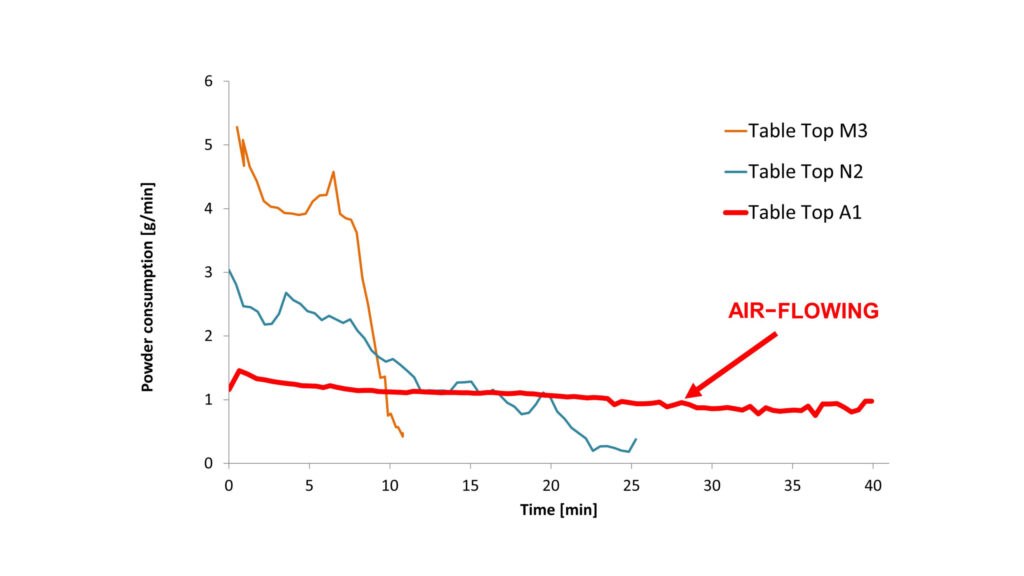
Das Ziel des professionellen Vorgehens ist die vollständige Entfernung des Biofilms bei gleichzeitiger Substanzschonung [26, 27, 28] und einem hohen Patienten- und Behandler-Komfort. Die Begriffe Air-Polishing und Air-Flowing werden oft synonym verwendet, unterscheiden sich aber erheblich und müssen gegeneinander abgegrenzt werden: Beide Systeme arbeiten nach demselben Prinzip der Pulver-Wasser-Strahl-Technologie. Beim Air-Flowing handelt es sich um ein technisch, physikalisch und chemisch abgestimmtes System (Airflow Prophylaxis Master Gerät (Abb. 2), Airflow-, Perioflow-Handstück (Abb. 3), minimalinvasives, erythritolbasiertes Airflow PLus Pulver). Der Airflow Prophylaxis Master ist das einzige Gerät, das mit einer konstanten und regulierten Pulver-Fließrate und laminarer Strömung arbeitet, im Gegensatz zum Air-Polishing mit einer turbulenten und weniger regulierten Pulver-Fließrate (Abb. 4).

Schritt 7: Qualitätskontrolle
Durch die Selbstkontrolle prüft der Prophylaxe-Mitarbeiter den Perfektionsgrad der durchgeführten Behandlung. Danach erfolgt die Kontrolle und Dokumentation der durchgeführten Behandlung im Vergleich zum Ausgangsbefund durch den Zahnarzt. Er evaluiert die individuellen Erkrankungsrisiken, erstellt die Abschlussdiagnose und plant eventuell notwendige weitere Therapien. Die Aufsicht des Zahnarztes ist für eine ordnungsgemäße Delegation auch von der gesetzgeberischen Seite her in Deutschland unerlässlich.
Am Ende der nichtchirurgischen Behandlung der periimplantären Mukositis und/oder der Periimplantitis werden oft lokale antimikrobielle Substanzen (Chlorhexidindiglukonat (CHX), Mundspülungen oder Natriumhypochlorid) unterstützend angewendet.
Schritt 8: Recall-Intervalle
Die Bedeutung der Erhaltungstherapie für die orale Gesundheit [12] und den Erhalt der Gesundheit von periimplantären Geweben ist schon lange bekannt. Luengo F et al 2023 fanden heraus, dass die Einhaltung eines strengen UIT-Protokolls die periimplantären Gewebe nach einem Jahr gesund erhält bzw. die postoperativen Ergebnisse sogar verbessert werden [35].
Stiesch M et al 2023 haben eindrücklich auf die Bedeutung der UIT hingewiesen. Die Bereitstellung von UIT nach einer Periimplantitis-Therapie kann das Wiederauftreten oder Fortschreiten der Krankheit verhindern. Es liegen jedoch noch keine ausreichenden Erkenntnisse vor, um ein spezifisches Protokoll für die unterstützende Pflege zur Tertiär-Prävention von Periimplantitis, die Wirkung zusätzlicher lokaler antiseptischer Mittel und die Auswirkungen der Häufigkeit der unterstützenden Pflegemaßnahmen zu ermitteln. Die angewendeten Protokolle sollten eine Kombination von präventiven und therapeutischen Interventionen in regelmäßigen Abständen sein. Sie sollten auf die spezifischen Bedürfnisse des Patienten abgestimmt sein [38].
Mit der GBT steht ein solches Protokoll zur Verfügung, da alle Anforderungen an die moderne orale Medizin erfüllt werden: GBT ist „Prädiktiv, Präventiv, Personalisiert, Partizipativ“, sowie minimalinvasiv und maximal effektiv.
Resümee
Derks et al 2015 zeigten in einem systematischen Review, dass die Prävalenz für die periimplantäre Mukositis 43 % und 22 % für Periimplantitis beträgt [39]. Nach fünf Jahren wurde aus einer klinisch manifesten periimplantären Mukositis ohne Therapie in 43,9 % eine Periimplantitis [40]. Die Arbeit von Costa et al 2012 konnte die Bedeutung einer regelmäßigen vorbeugenden Therapie zeigen. In der Kontrollgruppe (mit regelmäßigen vorbeugenden Maßnahmen) sank die Inzidenz der periimplantären Mukositis von 43,9 % auf 18,0 % [41]. Zusammengefasst heißt das: Das Fehlen einer präventiven Therapie (UIT) kann zu periimplantären Infektionen führen. Ohne UIT ist die periimplantäre Mukositis mit einer hohen Inzidenz von Periimplantitis verbunden. Unbehandelt führt die Progression der Periimplantitis zum Implantatverlust [8].
Das wiederum bedeutet zusammengefasst: Im vorliegenden Artikel besteht ein grundsätzlicher Konsens mit der aktuellen S3-Leitlinie „Die Behandlung periimplantärer Infektionen an Zahnimplantaten“ [41, 42] hinsichtlich einer systematischen unterstützenden Behandlung (UIT).
Eine Diskrepanz zu den S3-Leitlinien tritt bei der Bewertung auf, welche Therapie-Hilfsmittel (PZR/PMPR) bei einer periimplantären Mukositis zu einer Verbesserung der klinischen Parameter führen. Laut S3-Leitlinie sollten alternative Verfahren (Glycinpulver basiertes Air-Polishing, Chitosan Bürste) zur Biofilmentfernung bei der periimplantären Mukositis nicht zum Einsatz kommen, da alternative Verfahren zur Biofilmentfernung keinen zusätzlichen klinischen Effekt im Vergleich zu einem konventionellen Debridement (Ultraschall Scaler mit Karbonfaserspitzen, Teflon-/Titanküretten, RCP) zeigten. Diese Aussage der Leitlinien steht im krassen Gegensatz zu den im Kapitel „Literatur-Vergleich der Hilfsmittel“ aufgeführten wissenschaftlichen Arbeiten. Auch beim Vergleich der Literatur zur Therapie der Gingivitis [37] wird diese Diskrepanz sichtbar.
Es muss außerdem hinterfragt werden, warum bei einer subgingivalen Biofilmentfernung an natürlichen Zähnen mit Air-Polishing/Air-Flowing drei Mal mehr Biofilm entfernt werden kann und dies bei der periimplantären Mukositis nicht der Fall sein soll [43, 44, 45, 46]. Die Substanzschonung sowie der Patienten- und Behandler-Komfort werden in den S3-Leitlinien nicht erwähnt.
Konsens mit den S3-Leitlinien besteht mit der oben angeführten Literatur bei der nichtchirurgischen Therapie der Periimplantitis. Hier sollten laut S3-Leitlinien alternative Verfahren zur Biofilmentfernung (Air-Polishing/Air-Flowing) zum Einsatz kommen.
Vergleich der Hilfsmittel in der Literatur
Da die PZR/PMPR im Rahmen der systematischen Prophylaxe eine besonders wichtige Rolle spielt, wird hier ein aktueller Literaturüberblick über die bei der nichtchirurgischen peri- implantären Mukositis und Periimplantitis zum Einsatz kommenden Hilfsmittel gegeben:
- Figuero et al 2014: Die Therapie der periimplantären Mukositis und die nichtchirurgische Therapie der Peri- implantitis umfassen in der Regel ein mechanisches Debridement der Implantatoberfläche mit Küretten, Ultra- schallgeräten, luftabrasiven Geräten oder Lasern, mit oder ohne begleitende Verwendung von lokalen Antibiotika oder Antiseptika. Kontrollierte klinische Studien zeigen eine Verbesserung der klinischen Parameter, insbesondere der Blutung bei der Sondierung für die Mukositis. Bei Peri- implantitis sind die Ergebnisse begrenzt, insbesondere was die Verringerung der Sondierungstiefe betrifft [18].
- Nastri et al 2014: Ziel der Untersuchung war es, die Effek- tivität von Erythritol-Pulver-AirFlow (EPA) mit Ultraschall- anwendung (Piezon/PI) und Teflon-Küretten in der nicht- chirurgischen Periimplantitis-Therapie bei moderater Peri- implantitis zu vergleichen. Nach drei Monaten zeigte sich eine signifikante Reduktion bei PPD, MR, CAL in der EPA- Gruppe gegenüber den Kontrollgruppen. Die Effizienz des EPA war der mechanischen Therapie (Ultraschall plus Teflon-Küretten) überlegen. Die mit EPA benötigte durch- schnittliche Behandlungszeit betrug 3.25 Minuten, die der Kontroll-Gruppe 13.50 Minuten. Sowohl Patienten als auch die Behandler bevorzugten die EPA-Methode [23].
- Drago et al 2014: Das Ziel dieser Untersuchung war es, in vitro den antibakteriellen und antimikrobiellen Effekt von Erythritol-Pulver-AirFlow (EPA) gegenüber Glycin-Pulver- Airflow (GPA) zu untersuchen. Bei den untersuchten Bak- terienstämmen und Pilzen (Staphylococcus aureus, Bacte- roides fragilis und Candida albicans) zeigte EPA einen größeren antibakteriellen und antimikrobiellen Effekt als GPA [24].
- Schwarz et al 2015: Das Luftpolieren mit Glycinpulver (GPA) ist genauso wirksam wie das klassische mechanische Debridement bei Mukositis. Die Wirksamkeit der nichtchirurgischen Behandlung von Periimplantitis kann mit GPA die untersuchten Kontrollmaßnahmen verbessern. Eine vollständige Heilung der Krankheit wurde in der Regel nicht erreicht [25].
- Ronay et al 2017 untersuchten das Reinigungspotenzial gängiger Implantat-Debridement-Methoden, die eine nichtchirurgische Periimplantitis-Therapie in vitro simu- lieren. Pulver-Wasser-Strahl-Geräte (AP) zeigten bei allen Defektwinkeln signifikant bessere Ergebnisse. Die REM- Auswertung zeigte erhebliche Oberflächenveränderungen nach der Instrumentierung mit Gracey-Küretten und Ultra- schallgeräten, während Glycinpulver (GPA) zu keinerlei Oberflächenveränderungen führte [26].
- Tuchscheerer et al 2017 untersuchten die Wirksamkeit von chirurgischem und nichtchirurgischem Luftpolieren (AP) in vitro zur Dekontamination von Implantatober- flächen. Die Schlussfolgerung lautete: „Luftpolieren ist eine effiziente, oberflächenschonende Methode zur chirurgischen und nichtchirurgischen Dekontamination von Implantat Oberflächen“ [27].
- Mensi et al 2018 kamen zu folgenden Schlussfolgerungen: Sowohl Natriumbicarbonat als auch Erythritol-Pulver sind gute Hilfsmittel für das Luftpolieren der Implantatober- fläche. Keines der Pulver führte zu einer signifikanten Erhöhung der Oberflächenrauheit von Titan. Dadurch wird die Möglichkeit der Adhäsion von Bakterien verringert. Natriumbicarbonat und Erythritol erwiesen sich als wirk- sam bei der Entfernung von Plaque und der Verhinderung von Adhäsion. Die beste Anti-Biofilm-Wirkung gegenüber den betrachteten Stämmen (Staphylococcus aureus und Aggregatibacter actinomycetemcomitans) zeigte das Erythrit-Pulver [28].
- Iatrou et al 2021: Die Luft-Pulver-Abrasion (AP) erwies sich in diesem In-vitro-Modell für jede Art von Defekt als die effizienteste nichtchirurgische Behandlungsmethode mit der geringsten sichtbaren Oberflächenveränderung. Keine Dekontaminationsmethode führte zu einer vollständigen Reinigung der Implantat Oberfläche [29].
- Hatz et al 2022: Hinsichtlich der aktiven Behandlung von periimplantärer Mukositis und Periimplantitis konnten vier systematische Übersichten kein verbessertes klinisches Ergebnis zeigen, wenn Pulver-Wasser-Strahl-Geräte (AP) als Ergänzung zu konventionellen Behandlungsmaßnah- men eingesetzt wurden. In systematischen Übersichten, die auch die Patientenwahrnehmung untersuchten, wurde AP von den Patienten schmerzfreier und wesentlich ange- nehmer empfunden. Die Behandlungszeit mit AP war deutlich kürzer [30].
- Ichioka et al 2023: Bei der Oberflächendekontamination zeigte Air-Flowing eine hervorragende Biofilm-Eliminie- rung und reduzierte den atomaren Anteil von Kohlenstoff auf Implantatoberflächen im Vergleich zum reinen Ab- wischen mit Gaze. Die Verwendung eines zusätzlichen chemischen Mittels zu Air-Flowing zeigte keinen zusätz- lichen Vorteil [31].
- Francis et al 2023 zeigten in einer In-vitro-Studie, dass bei sechs Pulvern, die heute für das Air-Polishing verwendet werden, Biofilm bis ca. 90% reduziert werden kann. Es wurden keine relevanten Veränderungen der mikrosko- pischen Ultrastruktur der Oberflächen festgestellt. Air- Flowing mit erythritolbasiertem Plus-Pulver zeigte die höchste Effizienz bei der Biofilmentfernung [32].
- Fischer et al 2023 konnten feststellen, dass unter den drei Modalitäten für die Behandlung von Implantatoberflächen (Küretten, Ultraschall-Scaler und Air-Flowing mit ery- thritolbasiertem Plus-Pulver) Air-Flowing die effizienteste Reinigungsmethode war. Darüber hinaus wurden im Ver- gleich zu den anderen Methoden mit Air-Flowing keine Titanpartikel freigesetzt oder strukturelle Veränderungen nachgewiesen [33].
- Korello et al 2023 kamen zu dem Ergebnis, dass die Reinigungseffizienz in der Reihenfolge Airflow, Airscaler, Küretten in der nichtchirurgischen und chirurgischen Oberflächendekontamination von Implantaten signifikant abnimmt. Die REM-Aufnahmen zeigten schwere Ober- flächenschäden nach der Anwendung von Kürette und Airscaler [34].
- Luengo F et al 2023 verglichen in einer 12-monatigen postoperativen unterstützenden periimplantären Therapie (UIT) mechanisches Ultraschall Debridement (Piezon PI), Air-Flowing und RCP. Air-Flowing zeigte eine statistisch signifikante Reduktion der Sondierungstiefen (PD). Darüber hinaus wurde auch die BoP (Bleeding on Probing) in der Testgruppe mit Air-Flowing reduziert.
- Brandenberger et al 2023 zeigten den Einfluss der Reinigung mit Air-Flowing, Piezon/PS (PUS) im Zusammen- hang mit dem Implantatschulterdesign. In den oberen Zonen (obere marginale/Zone A und untere marginale Schulter/Zone B) war Air-Flowing bei einem neuen Schulter-Design fast 100 % effizient, während Ultra- schall (Piezon/PS) nur 80–90 % wirksam war. Bei Kontroll- implantaten (altes Schulterdesign) lagen die Ergebnisse für Air-Flowing und Piezon/PS PUS in Zone A ebenfalls bei fast 100 %. In der Zone B nur bei 55–75 %. Bei beiden Implantaten zeigte Air-Flowing eine signifikant höhere Wirksamkeit als PUS [36].
- Mensi M et al 2022: Das Ziel der Arbeit war es, eine Bewertung der klinischen Wirksamkeit bei Beseitigung von Gingivitis mit Hilfe eines GBT– Protokolls zu untersuchen. Bei der PZR/PMPR wurde Air-Flowing/PUS versus Piezon/PS (PUS)/RCP verglichen. Die Ergebnisse: Das Air-Flowing/ PUS-Protokoll (GBT) eignet sich für die kurzfristige Besei- tigung von plaqueinduzierter Gingivitis deutlich besser als Piezon/PS (PUS)/RCP. Außerdem war die Air-Flowing/ Piezon/PS (PUS)-Behandlungszeit im Durchschnitt 9,2 % kürzer als Piezon/PS (PUS)/RCP und wurde von einer signifikant höheren Zahl von Patienten bevorzugt [37].
Zusammenfassung: Anhand der Literatur zu der beim mechanischen Biofilm- und Zahnsteinmanagement zum Einsatz kommenden Hilfsmittel wird gezeigt, wie die PZR/ PMPR effektiv, substanzschonend und zugleich mit einem hohen Patienten- und Behandlerkomfort durchgeführt werden kann.

Dr. Klaus Dieter Bastendorf
hat als Zahnarzt und Wegbereiter für die Prävention in der Praxis über 750 Vorträge über dieses Thema gehalten und zahlreiche Artikel darüber verfasst. Seit 1979 eigene Praxis in Eislingen, seit 2014 in der Praxis Dr. Strafela-Bastendorf.
www.strafela-bastendorf.de
info@bastendorf.de

Dr. Nadine Strafela-Bastendorf
ist seit Dezember 2013 in eigener Praxis in Eislingen niedergelassen. In ihrer Familienpraxis bietet sie die Leistungen Individualprophylaxe, Parodontologie, Kinderzahnheilkunde, Zahnerhaltung, Zahnersatz und Bleaching an.
www.strafela-bastendorf.de
praxis@strafela-bastendorf.de
